Wie verhalten sich Stoffe in Böden? Wie sind die Stoffe zusammengesetzt? Und in welcher Form liegen die Stoffe in unseren Böden vor?
Wie Chemie in Böden abläuft hängt wesentlich von den Mineralbeständen und Korngrößen ab. Die haben großen Einfluss auf den pH-Wert und die innere, reaktive Oberfläche Meistens gibt das Ausgangsgestein die Mineralbestände und Korngrößen vor.
Neben dem Ausgangsgestein beeinflussen zum Beispiel sauer wirkende Nadelstreu, der pH-Wert des Niederschlags, Düngemittel oder Pflanzenschutzmittel die Chemie in Böden.
Böden reagieren vielfältig
Chemische Reaktionen in Böden wandeln Stoffe um, bilden neue Stoffe mit neuen Eigenschaften und machen Stoffe mobil oder immobil. Je nachdem, ob der pH-Wert eher sauer, neutral oder alkalisch ist, laufen diese chemischen Reaktionen schneller oder langsamer ab.
pH-Wert
Saure, neutrale oder alkalische Böden? Das geben Bodenkundlerinnen und Bodenkundler mit dem pH-Wert an. Der beschreibt die Menge der freien, sauer wirkenden Protonen (H+) in der Bodenlösung. Der pH-Wert beeinflusst zum Beispiel:
- Aktivität und Artenvielfalt des Bodenlebens,
- Wachstum von Pflanzen,
- Zusammensetzung von Pflanzengesellschaften,
- Aufbau und Abbau organischer Bodensubstanz,
- Stabilität des Gefüges,
- Verfügbarkeit von Nährstoffen,
- chemische Reaktionen in Böden,
- Verwitterung, Neubildung und Zerstörung von Tonmineralen,
- Löslichkeit und Mobilität von Eisen, Aluminium und Schwermetallen in der Bodenlösung.
Carbonate
Carbonate sind Puffersubstanzen, die den pH-Wert von Böden bei sauer wirkenden Einträgen nahezu konstant halten. In Böden kommen meist Calciumcarbonate wie Calcit (CaCO3) und Magnesiumcarbonate wie Dolomit (CaMg[CO3]) vor. Weil Carbonate aber wasserlöslich sind, kann Sickerwasser die Carbonate nach unten verlagern oder in das Grundwasser auswaschen. Das trägt zur natürlichen Versauerung von Böden bei.
Wie gut erfüllen Böden die Bodenfunktion Säurepuffer? Um das zu bewerten, ermitteln Bodenkundlerinnen und Bodenkundler auch den Carbonatgehalt. Bei der Profilaufnahme im Gelände geschieht das zum Beispiel mit Salzsäure.
Kalkung auf Äckern
In der Landwirtschaft werden Carbonate wie Calcit künstlich auf die Äcker gebracht. Solche Kalkungen gleichen den Verlust von Carbonaten durch Sickerwasser aus und halten den pH-Wert konstant.
Kationen
In Böden sind Kationen unter anderem wichtige Nährstoffe für Pflanzen. Zum Wachsen brauchen Pflanzen Kationen wie Calcium (Ca2+), Magnesium (Mg2+), Natrium (Na+) und Kalium (K+). Aber auch potenzielle Schadstoffe wie Blei (Pb), Cadmium (Cd) oder Quecksilber (Hg) können als Kationen in die Bodenlösung gelangen.
Austausch von Kationen
Alle Kationen sind positiv geladen. Negativ geladene Tonminerale und Huminstoffe können Kationen wie Magneten an sich binden. Um an die Kationen zu gelangen, geben Pflanzen über die Wurzeln Protonen (H+) an die Bodenlösung ab. Weil sich Protonen sehr einfach an Tonminerale binden, werden die Kationen verdrängt. Die so ausgetauschten Kationen nehmen die Pflanzen dann aus der Bodenlösung als Nährstoffe auf.
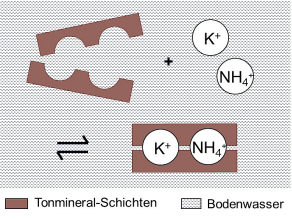 Schema: Spezifische Bindung von Kalium (K+) und Ammonium (NH4+) zwischen den Schichten eines Tonminerals
Schema: Spezifische Bindung von Kalium (K+) und Ammonium (NH4+) zwischen den Schichten eines Tonminerals
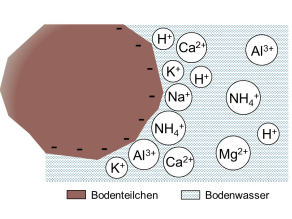 Schema: Unspezifische Bindung von Kationen auf der reaktiven Oberfläche der Bodenmatrix und ausgetauschte Kationen in der Bodenlösung.
Schema: Unspezifische Bindung von Kationen auf der reaktiven Oberfläche der Bodenmatrix und ausgetauschte Kationen in der Bodenlösung.
Böden mit vielen Tonmineralen und austauschbaren Kationen versorgen Pflanzen besonders gut mit Nährstoffen. Darum bestimmen Bodenkundlerinnen und Bodenkundler die Kationenaustauschkapazität (KAK).
| KAKpot | KAKeff |
|---|---|
| Die KAKpot wird bei einem definierten, schwach alkalischen pH-Wert von 8,2 gemessen. Das Ergebnis liefert die mögliche Anzahl der Bindungsplätze für Kationen an Tonmineralen und Huminstoffen. |
Die KAKeff wird bei dem pH-Wert gemessen, der im untersuchten Boden vorliegt. Das Ergebnis liefert die tatsächliche Anzahl der Bindungsplätze für Kationen an Tonmineralen und Huminstoffen. |
Basen
Für Bodenkundlerinnen und Bodenkundler sind das alle Kationen, die basisch wirken und den pH-Wert in Böden senken. Beispiele sind Calcium (Ca2+), Magnesium (Mg2+) und Kalium (K+).
Viele Basen sind Nährstoffe für Pflanzen. Mit dem Basensättigungsgrad (BS) geben Bodenkundlerinnen und Bodenkundler an, wie viele der Kationen in Böden Basen sind. Das hilft zum Beispiel bei der Bewertung der Natürlichen Ertragsfähigkeit.
Basen. Protonen. pH-Wert.
Je weniger Basen die Bodenlösung enthält, desto mehr Protonen (H+) müssen Pflanzen über die Wurzeln abgeben. Denn das löst Nährstoffe von den Tonmineralen und Huminstoffen.
Je größer die Menge der freien, sauer wirkenden Protonen (H+) in der Bodenlösung, desto geringer der pH-Wert.


