In vitro Testverfahren zielen als zellbasierte Biotestverfahren darauf ab, dass Schadstoffe Effekte in Zellen hervorrufen, die grundsätzlich auch auf den gesamten Organismus übertragen werden können. Durch diese alternativen Verfahren werden manche Tierversuche überflüssig.
umu-Test: Nachweis primärer DNA-Schäden bei Bakterien
Gentoxizität ist die reversible oder irreversible Schädigung des Erbgutes (DNA) durch chemische Substanzen oder physikalische Einflüsse. Irreversible Veränderungen an der DNA können mutagen (dauerhaft vererbbar), kanzerogen (krebsauslösend) oder teratogen (fruchtschädigend) sein. Mit dem umu-Test können primäre DNA-Schäden bestimmt werden, die reversibel oder irreversibel sein können.
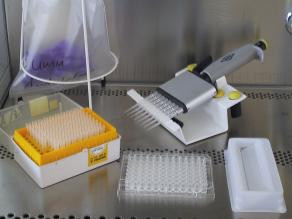 Die Durchführung des umu-Tests erfolgt in Mikrotiterplatten, mit einem gentechnisch veränderten Bakterienstamm können innerhalb weniger Stunden gentoxische Wirkungen durch Umweltchemikalien nachgewiesen werden
Die Durchführung des umu-Tests erfolgt in Mikrotiterplatten, mit einem gentechnisch veränderten Bakterienstamm können innerhalb weniger Stunden gentoxische Wirkungen durch Umweltchemikalien nachgewiesen werdenBei der Untersuchung von Wasser und Abwasser hat sich der umu-Test nach DIN 38415-3 bewährt. Hierbei können mit Hilfe eines gentechnisch veränderten Bakterienstammes gentoxische Wirkungen innerhalb weniger Stunden festgestellt werden. Der Testorganismus, das Bakterium Salmonella typhimurium, wurde dabei so modifiziert, dass (a) Chemikalien besser in die Zelle eindringen können, (b) DNA-Schäden erkannt, aber nicht mehr repariert werden können und (c) bei DNA-Schädigung ein bestimmtes Enzym produziert wird, das eine verfahrenstechnische Bestimmung mittels Farbumschlag erlaubt. Da Bakterien von sich aus keine stoffwechselaktiven Leberenzyme besitzen, wird in einem parallelen Testansatz ein Enzymgemisch von Säugetieren zugesetzt. Auf diese Weise können neben der ursprünglichen Substanz auch metabolisch entstandene Gentoxine erfasst werden.
Ames-Fluktuationstest: Nachweis vererbbarer DNA-Schäden bei Bakterien
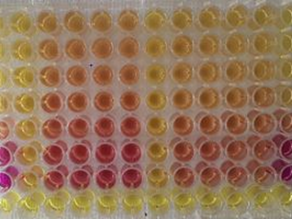
 Durchführung des Ames-Fluktuationstests in Mikrotiterplatten: der Farbumschlag von violett nach gelb zeigt ein Wachstum der Bakterien und somit Rückmutationen an
Durchführung des Ames-Fluktuationstests in Mikrotiterplatten: der Farbumschlag von violett nach gelb zeigt ein Wachstum der Bakterien und somit Rückmutationen anDas Prinzip der Bestimmung der gentoxischen Wirkung beruht beim Ames-Test auf der Induktion von Rückmutationen bei Bakterien-Mutanten durch im Testgut vorhandene Substanzen. Bei den Testbakterien handelt es sich um Salmonella typhimurium-Stämme, die nicht in der Lage sind, in histidinfreien Nährmedien zu wachsen. Unter Einwirkung gentoxischer Substanzen kann es zu Mutationen kommen, die die Bakterien wieder dazu befähigen, die Aminosäure Histidin herzustellen. Diese können sich dann wieder in histidinfreiem Medium vermehren. Im Gegensatz zum konventionellen Ames-Test wird der Ames-Fluktuationstest (ISO 11350) in Flüssigmedien in Mikrotiterplatten durchgeführt. Dies führt zu einer wesentlichen Material- und Zeitersparnis. Darüber hinaus können die Ergebnisse statistisch besser ausgewertet werden.
YES-Test: Nachweis östrogener Aktivität
Der YES (Yeast Estrogen Screen) Test nach ISO 19040-1 ist eine bioanalytische Methode mit hoher Sensitivität zur Bestimmung der östrogenen Aktivität von Substanzen in Wasser und Abwasser. Als "Messgerät" dient gentechnisch veränderte Bäckerhefe (Saccharomyces cerevisiae) mit humanem Östrogenrezeptor. Die Bindung einer östrogen aktiven Substanz an den Östrogenrezeptor aktiviert ein Reportergen. Die Genexpression führt zur Bildung einer roten Farbreaktion. Die Intensität des Farbstoffs ist proportional zur Aktivierung des Östrogenrezeptors.